川の水から人獣共通感染症の病原体と保菌動物の候補を同時検出
1.病原性レプトスピラとは
病原性レプトスピラは多くの動物に感染する人獣共通病原細菌であります。本菌は、腎尿細管で増殖し尿中へと排出され、ヒトは、尿に汚染された川や土壌との接触により感染します。レプトスピラ症の軽症型の場合は風邪と似た症状を示しますが、重症型の場合は黄疸、出血、肝・腎臓の障害などの症状がみられます。沖縄県での患者発生は他県に比べて多く、河川でのレジャー等により集団発生が起きており、本県の生命線である観光産業へ大きく影響するものとして懸念されています。本症を制御し,対策戦略を計画するには、感染サイクルのキーポイントである環境中のレプトスピラの生態および感染リスクを上昇させる保菌動物の解明が必要であります。しかし、レプトスピラは環境中での濃度が低くいため検出が難しく、また、環境サンプルから菌体を単離・培養をすることも困難です。
2.環境DNAを用いたレプトスピラの検出法の開発
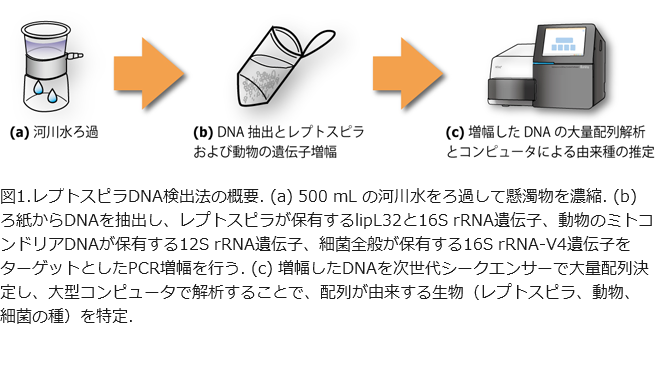
我々は、レプトスピラの生態的特徴を明らかにするために、新規な方法を開発しました。水中に存在する「環境DNA」に着目し、メタバーコーディング法にてレプトスピラが保有する遺伝子(lipL32と16S rRNA)と動物が保有する遺伝子(12S rRNA)をPCRの標的にすることによって、レプトスピラと同時に出現するレプトスピラの保菌動物の候補を検出する技術を開発しました。
具体的には、河川で採水を行い、ろ過により懸濁物を高度に濃縮してから(図1a)、DNAを抽出しました(図1b)。抽出された環境DNAから、レプトスピラと動物の遺伝子をPCR により増幅して、そのDNA配列を次世代シークエンサーという機器で大量解析しました(図1c)。
3.レプトスピラと保菌動物の候補を同時検出に成功
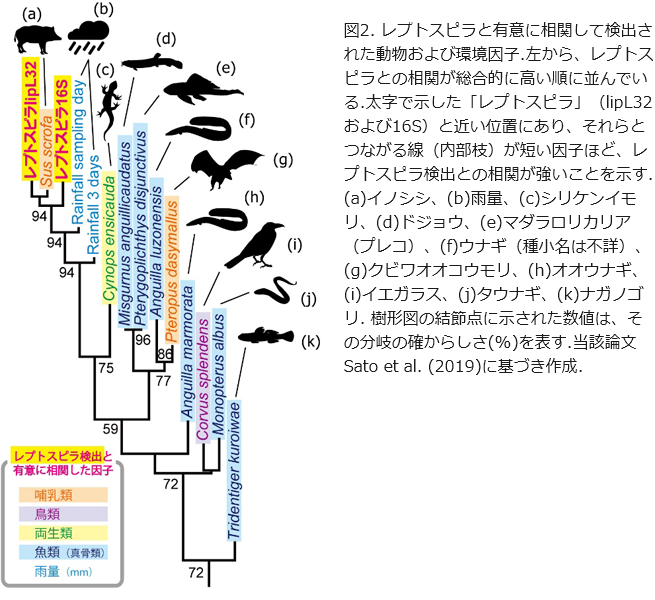
発した方法を用いて、夏季(7月~10月)にレプトスピラ症の発生が報告されている沖縄島の2つの河川で計80検体を解析した結果、病原性のLeptospira alstoniiやL. interrogans、中間型のL. wolffiiなど6種のレプトスピラが検出され、そのDNA配列数が採水時の雨の量と有意に相関することも確かめられました。さらに、同じ環境DNAサンプルを用いて、レプトスピラと同時に出現する動物のDNAを分析したところ、レプトスピラの保菌動物であることが知られるイノシシやオオコウモリなど10種の動物を特定することが出来ました(図2)。これらの動物の中には、レプトスピラとの関係が不明瞭な底生魚類やイモリなども含まれています。しかしながら、これらは保菌動物ではなく、雨による濁流と相関して検出されたに過ぎない可能性もあると考えられます。
以上の研究結果から、レプトスピラ症の予防においては、雨による濁流が見られる川や、イノシシなどの野生哺乳類が生息する付近の水場や泥土を避けるのが望ましいということが示唆されました。また、この研究によって開発された、環境DNA分析に基づくレプトスピラの直接検出と保菌動物候補の推定方法は、沖縄県だけでなく様々な国や地域にも適用できます。現在スリランカとの国際共同研究が進行中であり、スリランカの農業地帯でもレプトスピラ症のリスク評価、保菌動物の管理、衛生環境の改善などに役立てられることが期待されています。この研究は、琉球大学、新潟大学、神戸大学、ペラでニヤ大学の研究者によって行われたもので、細菌学、DNA分析学、生命情報科学、生態学の専門家など様々な分野の研究者が共同研究することによって実現しました (Sato et al, Scientific Reports, 2019)。
血管老化に関する臨床疫学研究
琉球大学病院第三内科が専門とする循環器・高血圧・腎臓・神経疾患は、一つの臓器ではなく全身の血管病を背景として発症することが多く、心・腎・脳ー血管連関とも呼ばれています。「人は血管とともに老いる」という言葉の通り、加齢は、粥状動脈硬化(血管が狭くなる)や動脈スティフネス(血管が硬くなる)の最大の危険因子で、有効な治療法はまだありません。当講座では、血管老化の病態や治療法解明のために臨床疫学研究に取り組んでいます。
1.足の血圧でわかる粥状動脈硬化
上腕血圧が高いほど脳心血管病発症が増加します。逆に、足(足関節)の血圧が低いほど脳心血管病発症リスクが高くなります。足の血圧は、同時に測定した上腕血圧との比(ABI)で評価し、足の血圧が上腕より10%以上低下したABI≤0.9になると、下肢動脈は有意に狭窄しています。その場合、全身の粥状動脈硬化が進んでいることが多く、脳心血管病発症率や死亡率が高くなります。我々は、沖縄県の人間ドック受診者(約1万3千人)を対象とした疫学研究を行い、60歳以上ではABI≤0.9の有病率が1%程度で、欧米人の10–20%に比べ極めて少ないこと報告しました(Eur. J. Prev. Cardiol. 2014)。
2.足の血圧でわかる大動脈スティフネスと小動脈硬化
足の血圧が高くても通常は問題にしません。ABIの正常値は1.0–1.39なので、上腕血圧が140mmHgの場合、足の血圧の正常値は140–194mmHgとなり、その差は50mmHg以上にもなります。はたして、足の高い血圧は上腕とは異なり問題にならないのでしょうか。我々は、50歳まではABIが加齢に伴い上昇することを世界で初めて明らかにしました(Circ J. 2016)。ABIが上昇するということは、収縮期血圧の上昇が上腕より足の方が急峻ということです。収縮期血圧の加齢変化は、大動脈スティフネスの進行と小細動脈硬化が原因と考えられています。そこで、「加齢に伴うABIの上昇は、動脈スティフネスや小動脈硬化の進行を反映し、ABIが高いほど臓器障害が進んでいる」という仮説を立てて検証し、以下のことを報告しました。
ABIが高いほど、
1)蛋白尿の有病率が多い(J. Hypertens. 2014)、
2)無症候性脳小血管病(微小脳出血、ラクナ梗塞、白質病変)が多い(J. Hypertens. 2016)、
3)左室肥大の有病率が多い(論文投稿中)、
4)腎の小動脈硬化が高度で、腎機能が低下している(Hypertens. Res. 2020)、
5)高血圧新規発症が多い(J Hypertens. 2019)、
以上のように、病態生理を考えることで、足の血圧ひとつから大動脈、中型動脈、小細動脈の変化がわかります。足の血圧の方が上腕血圧より病的変化が大きく、より鋭敏な血管老化のバイオマーカーである可能性があります。
3.「塩なし文化」住民における心臓・血管老化に関する研究
洋の東西を問わず文明社会では、収縮期血圧は加齢に伴い上昇します。収縮期血圧の上昇→動脈壁の弾性線維障害→動脈スティフネスの進行→収縮期血圧の上昇、という悪循環に陥ります。しかし、食塩摂取量が極端に少ない(3g/日以下)原始的生活を営む住民は、加齢に伴う血圧上昇がありません。ニューギニア島の中央高地に住むダニ族は、1938年に探検家により飛行機から発見され、初めて歴史に登場しました。現在も食塩摂取量が少なく、食事の大半はサツマイモです。2014年に我々は現地調査を行い、食塩摂取量が2.1g/日(日本人の1/5)、カリウム摂取量が6100mg/日(日本人の3倍)で、収縮期血圧の加齢変化がないことを確認しました。

予想に反して動脈スティフネスは加齢に伴い上昇していました(Hypertens. Res. 2018)。食事療法で血圧上昇の抑制は可能だが、動脈スティフネス抑制のためには別の方法を探索する必要があることがわかりました。2017年の再調査では心エコー検査も行いました。高齢者でも心臓の収縮能は保たれていましたが、拡張能は低下していました。動脈や心臓のコンプライアンスの低下は、収縮能の保たれた心不全、腎硬化症、認知症など高齢化社会で増加している疾患の病態生理に深く関係しています。その解決策を見い出せば、新たな治療法の開発につながります。
「ラクダ科VHH抗体作製技術を活用した低コスト生産性を有する感染症診断・治療薬の研究開発」
抗体は2本のH鎖と2本のL鎖の構成される分子量約150KDaの複雑なタンパク分子で、体内に侵入した抗原を特異的に認識して排除します。ラクダ科動物にはこのような一般的な抗体に加え、H鎖のみの2分子から構成される抗体が存在し、このH鎖抗体の抗原結合部位であるVHH(VH domain of H-chain antibody)は1つのドメインのみで標的抗原に結合する能力を持っています(図1)。このVHH抗体は約12.5KDaと低分子量であることから大腸菌などのタンパク質発現系で迅速に安価大量に生産することが可能です。また、温度・変性剤・pH変化などのタンパク質変性に対して高い耐性を有するなど、非常に安定な構造をしていることから長期保存安定性にも優れています。この様な性質から、現在VHH抗体は医療分野での活用は勿論のこと、電気機器などに組み込むバイオセンサーとしての応用も進められています。
一般的にVHH抗体を得るためには、大動物であるアルパカやラマなどのラクダ科動物に標的抗原を、複数回、時間を空けて免疫することが必要です。さらに、動物の飼育、免疫抗原の調整、都度のライブラリー作製等、高いコストと長い期間を要します。そこで寄生虫・免疫病因病態学講座では、動物免疫を必要としないVHH抗体作製法として、予め膨大な多様性を有するVHH抗体ライブラリーを作製し、少量の抗原のみを使用するスクリーニングにより、迅速にVHH抗体が開発できるシステムを構築しました。これは、11頭のアルパカ由来の血液から、約1億種類のVHH抗体遺伝子をPCRにより増幅し、このVHH遺伝子を前半部分と後半部分の2つの遺伝子に分離し、改めてランダムに結合させることで、計算上、約1京の新規VHH抗体遺伝子を生み出しました。最終的に、これを基に約200億種類のVHH抗体ファージディスプレイライブラリーを作製しました(図2)。
標的抗原に対するVHH抗体の取得は、パニング法と呼ばれるスクリーニングで行います(図3)。このパニング工程を2~3回繰り返すことで結合性ファージを濃縮した後、単クローン化を行います。本工程は6~10日で完了することから、微量の標的抗原さえあれば10日以内にVHH抗体が開発できます。実際、既に本法により、Ebolaウィルス、インフルエンザウィルス、ノロウィルス、新型コロナウイルスなど多種多様な標的抗原に結合するVHHクローンの単離に成功しています。さらに、ライブラリーを過酷な条件下(例:高温、変性剤等)でスクリーニングを行うことで、100度の熱処理や3M尿素存在下でも抗原に結合する超安定性VHHクローンが単離できるシステムも構築しました。
現在、これらのVHH抗体を用いた迅速簡易診断キットの開発を始め、VHH抗体を複数連結することで多特異性を発揮する抗体の開発、さらには、CAR-T細胞療法への応用や、癌化した組織など特異的な部位に薬剤等を運び込むドラッグデリバリーシステム(DDS)への応用を進めています。

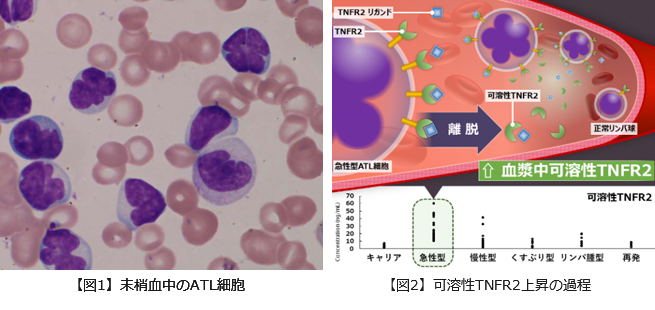
成人T細胞白血病リンパ腫の新規バイオマーカーの発見
1.成人T細胞白血病リンパ腫(ATL)について
ATLは、ヒトT細胞白血病ウイルスI型(HTLV-1)を原因とする血液悪性腫瘍です。HTLV-1キャリアは世界の中でも九州・沖縄に最も多く存在しており、ATLもこれらの地域に一致して発症しています。2008年度〜2010年度の厚生労働省科学研究班の全国調査では、全国のキャリア数は約108万人と推定されています。HTLV-1キャリアが生涯にATLを発症する割合は約5%で、大多数のキャリアは病気を発症することはありません。しかしながらATLを発症すると治癒は困難で、中でも急性型、リンパ腫型の高悪性度タイプはの生存期間中央値は8-10ヵ月と極めて予後不良です。ATLの治療成績向上を目指して、HTLV-1キャリアにおけるATLの発症危険因子を探索するための研究が行われ、高HTLV-1プロウイルス量などが示されていますが、明確に発症を予測する因子は分かっておりません。
2.沖縄HTLV-1/ATL研究ネットワークおよびバイオバンクの構築
沖縄県はHTLV-1キャリア割合が高く、ATL発症の多い地域です。2012年から沖縄県の中核病院を結ぶ沖縄HTLV-1/ATL研究ネットワークが設立され、その調査で県内に高悪性度ATLは年間約70例が発症していることが明らかになりました。そして沖縄県独自のATLに対する研究を推進していくため、HTLV-1キャリアおよびATL患者の生体試料および臨床情報を集積する沖縄HTLV-1/ATLバイオバンクが構築され、現在試料の数は500を超えています。
3.ATLの新規バイオマーカーを見出すための研究
琉球大学医学部保健学科血液免疫検査学分野、大学院医学研究科内分泌代謝・血液・膠原病内科学講座(第二内科)、免疫学講座、細胞病理学講座と日本電気株式会社(NEC)との共同研究チームは、ATLの早期診断をもたらす新規バイオマーカーの同定を目的として、SOMAscan (SomaLogic社、コロラド州、アメリカ)を用い、沖縄HTLV-1/ATLバイオバンクの血漿検体HTLV-1キャリア群、ATL患者群40ずつについて、1305種類の蛋白のプロテオーム解析を行い、両群間で比較検討しました。その結果333種類の蛋白で両群間に著明な差を認め、HTLV-1キャリアに比べATL患者で上昇していた210種類のタンパク質の中から、特に差の大きいタンパク質に注目し、ELISA法を用いた検証実験を行いました。そして可溶性tumor necrosis factor receptor 2 (TNFR2)がHTLV-1キャリアでは正常値であるのに対して、ATL患者、特に急性型において著明に上昇していることが判明し、ATL診断の新規バイオマーカーを見出しました。tumor necrosis factor(腫瘍壊死因子: TNF)はサイトカインで、その一種のTNF-αは固形がんに壊死を生じさせるサイトカインとして発見され、それ以外に発熱、炎症、細胞死の誘導、腫瘍発生、ウイルス複製の阻害などの生理作用を有していることが知られています。そしてTNFR2はTNF-αの受容体の一つで、いくつかの腫瘍で増殖に働きます。可溶性TNFR2は、TNFR2が細胞表面から離脱し血中に流れ出たもので、今後ATLの発症予測、早期診断、予後予測因子となるか、臨床的意義を探索する必要があります。またTNFR2が細胞表面から離脱する機序の解明も重要な課題です。その機序の解明が新規治療法の開発に繋がる可能性があると考えています。